La degenerazione maculare legata all’età (AMD) è stata descritta come la principale causa di cecità legale che colpisce il 10% -13% degli adulti sopra i 65 anni di età in Nord America, Europa, Australia e, di recente, Asia. L’AMD è un’importante sfida medica e socioeconomica per tutto il mondo e si prevede che la sua incidenza sarà almeno raddoppiata entro il 2020 sulla base dell’aumento della speranza di vita e di un impatto negativo crescente dei fattori di rischio ambientali, in particolare l’arteriosclerosi, l’obesità e il fumo. Inoltre l’AMD ha una profonda influenza sulla qualità della vita delle persone affette con un impatto simile all’AIDS, al danno renale e all’ictus.
Esistono due forme di AMD: quella secca o atrofica e quella umida o neovascolare. La forma secca può evolversi in quella umida ma non viceversa.
L’AMD secca, che ha un esordio subdolo e un decorso lento e progressivo, risulta dall’azione combinata di fattori genetici ed ambientali. Questa forma è molto più frequente della forma essudativa. La patogenesi è caratterizzata dal danno ossidativo, dall’accumulo di lipofuscina, dall’infiammazione cronica nel quadro di alterazioni del ”complemento”, dall’ischemia della coroide, da danni mitocondriali.
Nel normale processo del ciclo visivo si formano detriti cellulari provenienti dalla disgregazione dei dischi dei coni e bastoncelli che normalmente vengono eliminati senza conseguenze. Nella AMD secca i detriti, soprattutto la lipofuscina, ben visibile nelle immagini ad autofluorescenza, si accumulano sotto forma di drusen nello spazio sottoretinico portando ad una progressiva distruzione dell’epitelio pigmentato retinico (EPR). Il punto di partenza della degenerazione maculare sembra essere quindi un danno o un invecchiamento dell’EPR, che porta alla morte dei fotorecettori e ad una progressiva atrofia della coriocapillare. Il quadro terminale è quello dell’ atrofia geografica.
Lo studio AREDS, alla base di tutte le attuali terapie vitaminiche ed antiossidanti, è uno studio randomizzato, che ha dimostrato che i soggetti trattati con vitamina C, E, betacarotene e zinco, hanno un rischio molto minore di sviluppare la degenerazione secca rispetto a chi non segue questa supplementazione. Con lo studio AREDS 2 la formula delle sostanze antiossidanti è stata modificata. E’ stato ridotto lo zinco e sono stati aggiunti gli omega-3, la luteina e la zeaxantina. La luteina è una vitamina della famiglia dei carotenoidi che si trova in altissima concentrazione nella macula dove costituisce insieme alla zeaxantina il pigmento maculare fisiologico. Gli omega-3 hanno proprietà antiinfiammatorie. E’ stato eliminato il betacarotene, che aumenta rischio di tumore polmonare nei fumatori. I pazienti che hanno partecipato all’ AREDS2 hanno dimostrato un rischio di progressione diminuito del 18%.
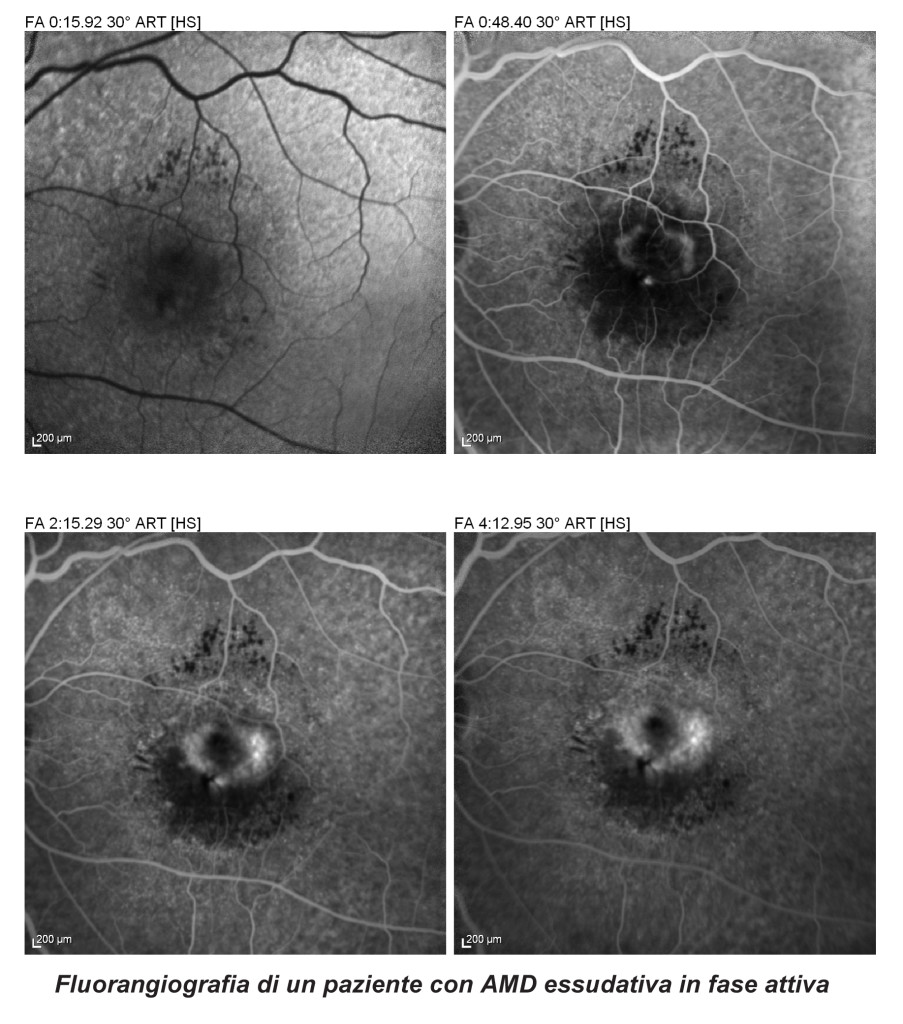
L’ AMD essudativa (o neovascolare) è invece una malattia ad esordio acuto e con una rapida progressione caratterizzata dalla formazione di neovasi anomali che si formano nello spazio sottoretinico e che vanno ad incidere in breve tempo sulla visione centrale. La diagnosi precoce e un attento follow-up sono determinanti affinchè la perdita del visus non diventi irreversibile.
I progressi nella ricerca medica hanno permesso di identificare il fattore di crescita endoteliale vascolare (VEGF) come un importante fattore fisiopatologico nella AMD essudativa e hanno reso l’inibizione intraoculare del VEGF come uno delle terapie più efficaci in medicina. L’ampia introduzione della terapia anti-VEGF ha portato ad un importante miglioramento nella prognosi dei pazienti affetti da AMD neovascolare, consentendo il recupero e il mantenimento della funzione visiva nella stragrande maggioranza dei casi. Dal 2006, anno dell’approvazione della farmacoterapia con anti-VEGF, la prevalenza della cecità legale e della diminuzione visiva causata da AMD è stata considerevolmente ridotta, eliminando l’AMD essudativa dal’elenco delle malattie incurabili.
Il medico che si trovi di fronte ad un paziente con riduzione del visus, metamorfopsie, visione di una macchia scura centrale, deve sempre chiedere al paziente se presenti una familiarità per AMD e le sue abitudini di vita come ad esempio il fumo di sigaretta. Si deve sempre procedere con un attento esame oftalmologico comprensivo della misurazione della migliore acuità visiva corretta (BCVA) e dell’esame del fondo oculare per l’individuazione di segni clinici quali l’edema intraretinico, il distacco del neuroepitelio (DNE) o dell’epitelio pigmentato retinico (DEP) o emorragie retiniche. Molto importante ai fini della diagnosi precoce è anche il cosiddetto “home monitoring” tra le visite di routine, cioè gli esercizi di monitoraggio della qualità della visione effettuati a casa da parte del paziente (Es. Griglia di Amsler). Numerosi studi clinici hanno dimostrato come si raggiungano i migliori risultati finali quando si parte da una migliore acuità visiva iniziale (AV).
Sfortunatamente nella maggior parte dei casi le lesioni sono rilevate quando vi è già una considerevole perdita della vista nell’occhio interessato. La ridotta efficacia della terapia con anti-VEGF nella vita reale rispetto ai trials clinici è spesso legata al ritardo nella diagnosi iniziale e ad un follow-up discontinuo. E’ stato dimostrato che negli Stati Uniti dal 2006 al 2011 i pazienti con AMD essudativa hanno ricevuto un numero di visite e di iniezioni troppo basso rispetto agli schemi di trattamento e di monitoraggio validati dai trials clinici. Uno studio tedesco multicentrico e retrospettivo ha evidenziato come dal 2008 al 2010 la maggiorparte delle lesioni riscontrate alle visite di routine siano state di tipo fibroso a dimostrazione del ritardo nella diagnosi.
Dal punto di vista terapeutico i farmaci anti-VEGF hanno drasticamente modificato la storia naturale e quindi la prognosi della AMD essudativa. Il VEGF aumenta la permeabilità vascolare incrementando la risposta infiammatoria e inducendo l’angiogenesi.
Lo studio Vision nel 2004 ha segnato una nuova era nel trattamento dell’AMD neovascolare dimostrando l’efficacia e la sicurezza della terapia con anti-VEGF e nello specifico del Pegaptanib (Macugen®), utilizzando come gruppo di controllo pazienti trattati con terapia fotodinamica, una delle poche opzioni terapeutiche possibili fino a quel momento. Il Pegaptanib è stato approvato dall’FDA per gli USA nel Dicembre 2004 per il trattamento di tutti i tipi di lesioni nell’AMD essudativa, approvazione arrivata in Europa da parte dell’European Medicines Agency (EMA) nel Gennaio 2006. Il pegaptanib è un aptamero, vale a dire un piccolo frammento di RNA sintetico che si lega con alta specificià ed affinità solo all’isoforma 165 del VEGF e le impedisce il legame con il proprio recettore, la conseguente formazione di vasi anomali e l’aumento della permeabilità vascolare. Ha un’emivita intravitreale media di 10 giorni.
Il Pegaptanib tuttavia presenta il limite di legare esclusivamente l’isoforma 165 del VEGF, limite superato dal farmaco approvato successivamente nella terapia dell’AMD essudativa, il Ranibizumab.
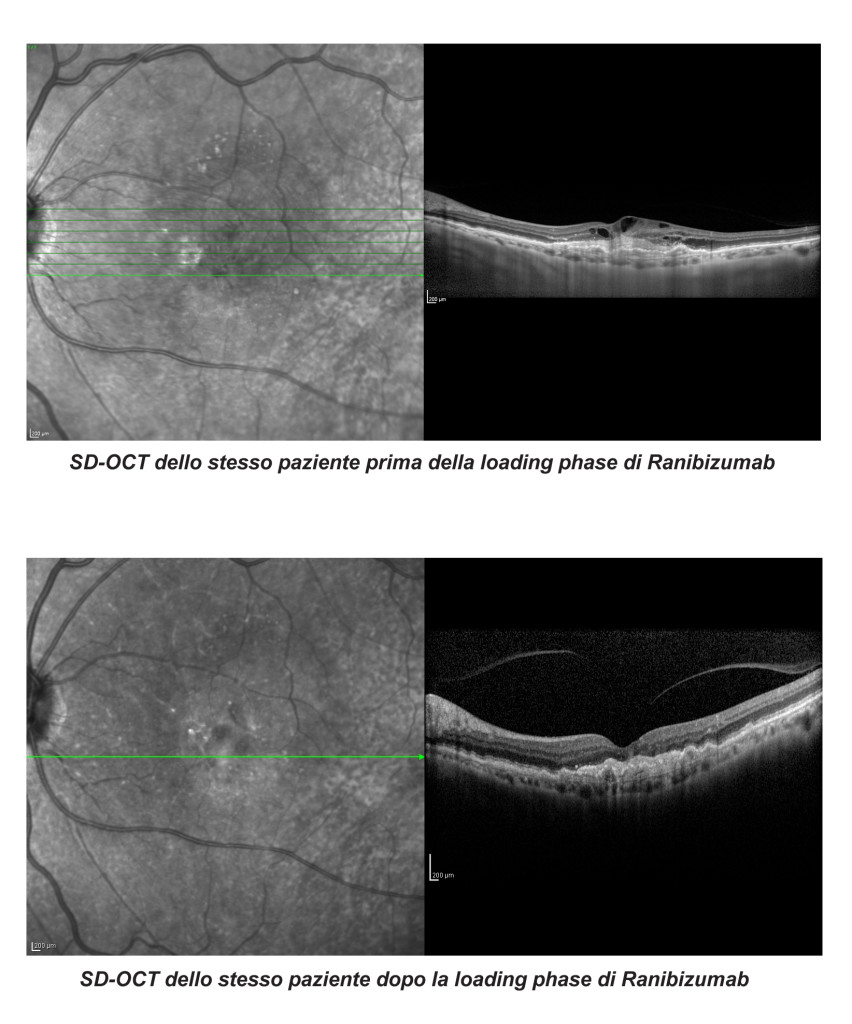
Il Ranibizumab (Lucentis®, Genentech, Novartis) è un frammento Fab umanizzato ricombinante di un anticorpo monoclonale che lega e blocca tutte le forme di VEGF (quelle solubili VEGF-165, VEGF-121, VEGF-110 e quelle tessutali VEGF-189 e VEGF-206) e per questo molto più efficace del Pegaptanib. Grazie alla rimozione del frammento Fc dell’anticorpo il suo peso molecolare è ridotto (48 kD) consentendo la maggior capacità di penetrare tutti gli strati della retina e quindi di diffondere nello spazio sottoretinico dopo somministrazione intravitreale; inoltre interferisce minimamente con l’inibizione sistemica del VEGF e non interferisce quindi con il suo ruolo fisiologico nei tessuti dei territori extraoculari. L’emivita intravitreale è di circa 2-4 giorni mentre la clearance sistemica molto rapida e la sicurezza quindi estremamente elevata. Per tutti questi motivi la monoterapia con Ranibizumab è diventata il trattamento standard per l’AMD essudativa.
Molto si è dibattuto e molti trials clinici sono stati effettuati per definire il dosaggio e i regimi di trattamento con Ranibizumab nei pazienti con AMD essudativa.
Il grosso dilemma riguarda soprattutto se preferire il regime fisso o quello flessibile (pro re nata-PRN).
Gli studi che hanno valutato i risultati di trattamenti a regime fissi sono stati: MARINA, ANCHOR, PIER ed EXCITE.
Gli studi MARINA e ANCHOR hanno dimostrato l’efficacia a un anno in termini di guadagno di acuità visiva della terapia con iniezioni mensili di Ranibizumab 0,3 e 0,5 mg in confronto, rispettivamente, a sham e PDT.
Lo studio PIER invece ha evidenziato la perdita in termini di acuità visiva dal passaggio da un trattamento con iniezioni mensili (loading phase dei primi 3 mesi) a iniezioni trimestrali nei successivi 21 mesi. Questa tendenza è stata successivamente confermata dallo studio EXCITE.
Il regime flessibile invece è stato valutato nei trials clinici PrONTO, CATT, SECURE e HARBOR.
Lo studio PrONTO ha valutato i risultati di iniezioni di Ranibizumab per i primi 3 mesi (loading phase) seguite da iniezioni PRN sulla base di criteri di ritrattamento, in particolare la BCVA e le caratteristiche morfologiche all’OCT. Questa strategia di ritrattamento ha permesso di raggiungere risultati simili a quelli degli studi MARINA e ANCHOR con meno della metà delle iniezioni richieste mensilmente in questi studi di fase III.
Lo Studio CATT è un trial clinico randomizzato, multicentrico il cui scopo è stato quello di confrontare l’efficacia e la sicurezza del Ranibizumab e del Bevacizumab comparando il regime fisso ed il PRN. Il criterio di ritrattamento principale era rappresentato dalla presenza di segni di essudazione all’OCT (TD-OCT) secondo il criterio della “tolleranza zero” (la presenza di qualsiasi fluido all’OCT dava indicazione per il ritrattamento). Dagli studi effettuati si può dedurre sia che Bevacizumab e Ranibizumab sono equivalenti dal punto di vista dell’efficacia sia che il trattamento “al bisogno” è efficace quanto il trattamento mensile sia utilizzando Ranibizumab che Bevacizumab. Sono emerse inoltre delle interessanti informazioni relative alla sicurezza oculare e sistemica dei due farmaci.
Gli studi HORIZON e SECURE rappresentano un’estensione dei trials precedenti per valutare l’efficacia e la sicurezza a lungo termine della terapia con Ranibizumab trattando con un regime PRN pazienti precedentemente sottoposti a regime fisso in trials quali MARINA, ANCHOR o EXCITE. Questi studi hanno mostrato una riduzione in acuità visiva, evidenziando la natura progressiva della malattia neovascolare e la necessità di un continuo e attento follow-up e di rigorosi e oggettivi criteri di ritrattamento.
Lo studio HARBOR è stato l’unico trial in cui si è utilizzato lo SD-OCT per il monitoraggio di pazienti trattati con 0,5 mg e 2,0 mg di Ranibizumab a regime PRN confrontati con un regime fisso (mensile). Questo studio ha confermato che 0,5 mg di Ranibizumab mensile fornisce ottimi risultati in pazienti con AMD essudativa e che non vi è alcuno svantaggio nell’utilizzo di un regime PRN rispetto alle iniezioni mensili a condizione che si garantisca un rigoroso monitoraggio mensile con SD-OCT.
Un altro possibile regime di trattamento flessibile è quello definito “Treat and Extend”. Dopo una loading phase di 3 iniezioni mensili si procede mensilmente fino ad assenza di attività della lesione. Se non sono presenti segni di attività si allunga il successivo intervallo di monitoraggio di 2 settimane (fino ad un massimo di 3 mesi), se sono invece presenti segni di attività si procede con l’iniezione e si riduce l’intervallo di 2 settimane. Questo protocollo “Treat and Extend” ha fornito risultati simili a quelli dei trials clinici registrativi con Ranibizumab mensile ma con un minor numero di iniezioni e di visite. Trials “Treat and Extend” sono attualmente in corso in Europa. Sebbene con questo regime sia alto il rischio di “sottotrattare” i pazienti, allo stesso modo andrebbero valutate le possibili complicazioni di un “sovratrattamento”. Il trattamento mensile di Ranibizumab infatti ha mostrato un sostanziale aumento del tasso di atrofia geografica (GA) rispetto agli occhi trattati con il regime al bisogno.
Quindi dai trials clinici è emerso che un regime terapeutico individualizzato è fattibile, ma un attento monitoraggio mensile e un rapido ritrattamento al bisogno sono necessari per non perdere l’efficacia della terapia. Un regime PRN in un contesto del mondo reale può portare dei risultati meno favorevoli rispetto a quelli riportati in studi clinici controllati. Infatti nella “real life” regimi PRN con follow-up mensile possono essere difficili da attuare.
RANIBIZUMAB
- Approvato per il trattamento di tutti i tipi di lesioni nell’AMD essudativa per gli USA dall’FDA nel Luglio 2006 e in Europa da parte dell’EMA nel Gennaio 2007
- Dose approvata: 0,5 mg.
- Si è dimostrato che un trattamento continuo per due anni in regime PRN con uno stretto monitoraggio con SD-OCT e con immediati ritrattamenti alla comparsa di fluido è un regime che assicura ottimi risultati in termini di outcome visivo.
- Etichetta ufficiale del prodotto in Europa: iniezioni intravitreali mensili continue fino al raggiungimento della massima AV e/o assenza di attività della malattia. Gli intervalli di monitoraggio e di trattamento devono essere decisi dal medico e basati sull’attività della patologia (AV e OCT), secondo un regime PRN o treat and extend.
- Pratica corrente in Europa: stretto monitoraggio con AV e OCT e cessazione del trattamento in assenza di fluido all’OCT.
- Raccomandazioni basate sui dati degli studi ANCHOR, MARINA, PIER, EXCITE, HARBOR e CATT (Evidenza livello I) e degli studi SECURE e HORIZON (Evidenza livello II)
Il Bevacizumab (AVASTIN®; Roche) è un anticorpo monoclonale umanizzato, prodotto mediante la tecnica del DNA ricombinante, che lega tutte le isoforme del VEGF. E’ stato approvato dall’FDA e dall’EMA per il trattamento per via endovenosa del tumore metastatico del colonretto e di altri tipi di tumore. L’emivita intravitreale è di 5.6 giorni ma quella sistemica è prolungata (circa 20 giorni) per la presenza del frammento FC, assente nel Ranibizumab, che lega il recettore delle cellule endoteliali portando ad un riciclo del farmaco.
Dati i costi notevolmente ridotti del Bevacizumab rispetto al Ranibizumab è all’ordine del giorno il dibattito circa l’opportunità di trattare pazienti con AMD essudativa con un farmaco off-label per l’AMD come il Bevacizumab piuttosto che con il più costoso Ranibizumab e molto attesi sono stati per questo i risultati di due trials clinici che hanno confrontato direttamente i due farmaci, lo studio CATT e lo studio IVAN.
Lo Studio CATT ha dimostrato che il Ranibizumab mensile ha la stessa efficacia in termini di stabilizzazione dell’acuità visiva del Bevacizumab mensile, che il Ranibizumab PRN è efficace tanto quanto il Bevacizumab PRN e che il Bevacizumab PRN risulta invece essere meno efficace del Ranibizumab mensile. Inoltre il trial ha messo in evidenza nei pazienti trattati con Bevacizumab una maggiore percentuale di eventi avversi sistemici severi rispetto al Ranibizumab sia nel primo (24.1% e 19.0% rispettivamente) che nel secondo anno (39.9% e 31.7% rispettivamente).
Nello studio IVAN 628 pazienti sono stati randomizzati in quattro gruppi: Ranibizumab o Bevacizumab mensile; Ranibizumab o Bevacizumab mensile per i primi 3 mesi di trattamento, seguiti da un ciclo di 3 iniezioni mensili solo in presenza di segni di neovascolarizzazione attiva (regime al bisogno o individualizzato). Sfortunatamente i disegni sperimentali dello studio IVAN non consentono di confrontare direttamente i quattro gruppi. Gli unici confronti possibili sono: Ranibizumab vs Bevacizumab (indipendentemente dal regime di trattamento) e regime di trattamento mensile vs PRN (indipendentemente dal tipo di farmaco). Il confronto tra i due farmaci si è dimostrato inconclusivo e il trattamento PRN ha evidenziato la stessa efficacia di quello fisso mensile. Da questi studi è emerso quindi che i farmaci risultano avere un’ efficacia sovrapponibile. Entrambi i farmaci si sono dimostrati sufficientemente sicuri per quanto riguarda gli eventi avversi oculari. Sebbene entrambi gli studi non siano stati disegnati per rilevare differenze nell’incidenza degli eventi avversi sistemici severi, sono stati riportati possibili problemi di sicurezza con Bevacizumab. Nello studio CATT, infatti, i pazienti trattati con Bevacizumab hanno un 30% di rischio in più di eventi avversi severi. Un’ approfondita analisi dei risultati dello studio IVAN ha confermato tale dato. In questo studio infatti si è rilevato un aumento del 25% di eventi avversi sistemici seri con l’utilizzo di Bevacizumab rispetto a Ranibizumab. Un dato molto interessante ci viene dallo studio IVAN in cui sono stati misurati i livelli sierici di VEGF dopo il trattamento iniettivo con entrambi i farmaci. I livelli sierici di VEGF risultano dimezzati con il Bevacizumab ed invariati con il Ranibizumab. Pertanto sia l’oculista che il paziente devono essere consci che la somministrazione intravitreale di Bevacizumab potrebbe comportare degli effetti anche a livello sistemico che possono tradursi in un’aumentata incidenza di eventi avversi. La cosa più importante da evidenziare è però che il CATT e l’IVAN non sono stati disegnati per identificare quelle differenze minime ma clinicamente significative in termini di sicurezza tra i due farmaci.
BEVACIZUMAB
- Approvato dall’FDA e dall’EMA per il trattamento per via endovenosa del tumore metastatico del colonretto e di altri tipi di cancro ma off-label per il trattamento dell’AMD essudativa.
- Gli studi CATT ed IVAN hanno evidenziato che Bevacizumab e Ranibizumab consentono entrambi degli ottimi risultati in termini di outcome visivo dimostrando la non inferiorità (NI) del Bevacizumab mensile rispetto al Ranibizumab mensile e del Bevacizumab PRN rispetto al Ranibizumab PRN. Il Bevacizumab PRN è risultato essere invece meno efficace del Ranibizumab mensile.
- Sicurezza: non sono a disposizione dati conclusivi e nessuno dei trials è stato disegnato per valutare la sicurezza. Tuttavia, l’evidenza dal confronto head-to-head tra i due farmaci è di un aumento del rischio di eventi avversi oculari e sistemici con Bevacizumab. L’impatto del Bevacizumab sulla concentrazione plasmatica del VEGF e la sua prolungata emivita in circolo potrebbero favorirne l’insorgenza..
- Devono essere valutate le condizioni fisiche di ogni paziente nella scelta della terapia più adatta con la consapevolezza che i pazienti inclusi nei trials non riflettono il profilo comune di rischio presente nella “real life”. Il Bevacizumab è sostanzialmente meno costoso ma ogni decisione sul trattamento deve essere presa sulla base di un accordo, sia medico che legale, tra medico e paziente.
- Raccomandazioni basate sui dati degli studi CATT ed IVAN (Evidenza livello I)
Di più recente introduzione nella gamma degli anti-VEGF è l’Aflibercept (EYLEA®; Bayer), una proteina di fusione completamente umana, potente inibitore dell’Angiogenesi, che lega tutte le isoforme del VEGF-A, VEGF-B nonché il Fattore di Crescita Placentare (PlGF).
La dimensione molecolare di aflibercept di 115 kDa risultanti in un’emivita intravitreale di 7,1 giorni, in una bioattività calcolata in occhi umani di 2,5 e in un’ emivita sierica di 18 giorni a causa della presenza della porzione Fc.
L’Aflibercept ha un’affinità di legame più alta del recettore naturale del VEGF e degli altri anticorpi anti-VEGF. Grazie al suo specifico meccanismo d’azione, l’Aflibercept intrappola e blocca il VEGF, impedendo il legame al suo recettore.
Gli studi VIEW1 e VIEW 2 hanno dimostrato come l’Aflibercept abbia un’ efficacia a uno e due anni simile al Ranibizumab con percentuali simili di miglioramento, anche se nello studio VIEW 1 aflibercept mensile ha fornito risultati visivi statisticamente superiori agli altri bracci di trattamento Questi studi sono stati alla base dell’approvazione del farmaco nel trattamento dell’AMD essudativa avvenuta nel 2012 da parte dell’FDA al dosaggio di 2.0 mg. Il regime suggerito da scheda tecnica infatti è quello di una loading phase di 3 iniezioni mensili seguite da iniezioni bimestrali senza necessità di monitoraggio. Dopo 12 mesi di trattamento l’intervallo può essere prolungato sulla base delle condizioni anatomiche e funzionali del singolo paziente.
AFLIBERCEPT
- Approvato dall’FDA nel 2012 per il trattamento dell’AMD neovascolare alla dose di 2,0 mg
- Etichetta ufficiale del prodotto in Europa: iniezioni mensili per i primi 3 mesi seguiti da un dosaggio fisso ogni otto settimane. Dopo 12 mesi di trattamento gli intervalli possono essere prolungati a seconda delle condizioni anatomiche e funzionali del singolo paziente
- Nessuna efficacia supplementare è stata dimostrata quando aflibercept è stato somministrato ogni 4 settimane rispetto alle 8 settimane. Nello studio VIEW 1 tuttavia aflibercept mensile ha fornito risultati visivi statisticamente superiori.
- Questo suggerisce l’opportunità di identificare i pazienti con una lesione più aggressiva che possano beneficiare di un regime mensile, come indicato nello studio VIEW 1
- Molti studi interventistici suggeriscono un’efficacia superiore dal punto di vista anatomico di Aflibercept rispetto a Ranibizumab e Bevacizumab
- Livello di evidenza I è fornito dagli studi VIEW I e II
Bibliografia
- Friedman DS, O’Colmain BJ, Munoz B, et al. Prevalence of age-related macular degeneration in the United States. Arch Ophthalmol 2004;122:564–72.
- Spilsbury K, Garrett KL, Shen WY, et al. Overexpression of vascular endothelial growth factor (VEGF) in the retinal pigment epithelium leads to the development of choroidal neovascularization. Am J Pathol 2000;157:135–44.
- Gragoudas ES, Adamis AP, Cunningham ET Jr, et al. Pegaptanib for neovascular age-related macular degeneration. N Engl J Med 2004;351:2805–16.
- Rosenfeld PJ, Brown DM, Heier JS, et al. Ranibizumab for neovascular age-related macular degeneration. N Engl J Med 2006;355:1419–31.
- Brown DM, Kaiser PK, Michels M, et al. Ranibizumab versus verteporfin for neovascular age-related macular degeneration. N Engl J Med 2006;355:1432–44.
- Brown DM, Michels M, Kaiser PK, et al. Ranibizumab versus verteporfin photodynamic therapy for neovascular age-related macular degeneration: two-year results of the ANCHOR study. Ophthalmology 2009;116:57–65 e5.
- Bressler NM, Chang TS, Suner IJ, et al. Vision-related function after ranibizumab treatment by better- or worse-seeing eye: clinical trial results from MARINA and ANCHOR. Ophthalmology 2010;117:747–56 e4.
- Rofagha S, Bhisitkul RB, Boyer DS, et al. Seven-year outcomes in ranibizumab-treated patients in ANCHOR, MARINA, and HORIZON: a multi center cohort study (SEVEN-UP). Ophthalmology 2013;120:2292–9.
- Schmidt-Erfurth U, Eldem B, Guymer R, et al. Efficacy and safety of monthly versus quarterly ranibizumab treatment in neovascular age-related macular degeneration: the EXCITE study. Ophthalmology 2011;118:831–9.
- Singer MA, Awh CC, Sadda S, et al. HORIZON: an open-label extension trial of ranibizumab for choroidal neovascularization secondary to age-related macular degeneration. Ophthalmology 2012;119:1175–83.
- Regillo CD, Brown DM, Abraham P, et al. Randomized, double-masked, sham-controlled trial of ranibizumab for neovascular age-related macular degeneration: PIER Study year 1. Am J Ophthalmol 2008;145:239–48.
- Silva R, Axer-Siegel R, Eldem B, et al. The SECURE study: long-term safety of ranibizumab 0.5 mg in neovascular age-related macular degeneration. Ophthalmology 2013;120:130–9.
- Hawkes N. Avastin is as effective as Lucentis for wet AMD and could save NHS 84 m pound a year, study shows. BMJ 2012;344:e3275.
- Martin DF, Maguire MG, Fine SL, et al. Ranibizumab and bevacizumab for treatment of neovascular age-related macular degeneration: two-year results. Ophthalmology 2012;119:1388–98.
- Chakravarthy U, Harding SP, Rogers CA, et al. Alternative treatments to inhibit VEGF in age-related choroidal neovascularisation: 2-year findings of the IVAN randomised controlled trial. Lancet 2013;382:1258–67.
- Schmidt-Erfurth U, Kaiser PK, Korobelnik JF, et al. Intravitreal aflibercept injection for neovascular age-related macular degeneration: ninety-six-week results of the VIEW studies. Ophthalmology 2014;121:193–201.
- Heier JS, Boyer D, Nguyen QD, et al. The 1-year results of CLEAR-IT 2, a phase 2 study of vascular endothelial growth factor trap-eye dosed as-needed after 12-week fixed dosing. Ophthalmology 2011;118:1098–106.
- Heier JS, Brown DM, Chong V, et al. Intravitreal aflibercept (VEGF trap-eye) in wet age-related macular degeneration. Ophthalmology 2012;119:2537–48.
- Argon laser photocoagulation for neovascular maculopathy. Five-year results from randomized clinical trials. Macular Photocoagulation Study Group. Arch Ophthalmol 1991;109:1109–14.
- Bressler NM. Photodynamic therapy of subfoveal choroidal neovascularization in age-related macular degeneration with verteporfin: two-year results of 2 randomized clinical trials-tap report 2. Arch Ophthalmol 2001;119:198–207.