Epidemiologia
Il melanoma dell’uvea è la neoplasia intraoculare primitiva maligna più frequente nell’adulto. Nella popolazione generale è un tumore da considerarsi raro, con un’incidenza di 5,3-10,9 casi per milione di persone per anno. Il numero maggiore di casi viene diagnosticato in persone di razza bianca nella sesta decade di vita, ad un’età media di 55 anni. Numerosi studi epidemiologici hanno analizzato i vari fattori predisponenti allo sviluppo del melanoma uveale, spesso con risultati contrastanti. Nella maggior parte degli studi è emersa una leggera predominanza per il sesso maschile. L’iride di colore chiaro, un fototipo chiaro e una propensione alle scottature solari rappresentano altri fattori associati a un aumento statisticamente significativo del rischio, anche se un meccanismo diretto da parte delle radiazioni UV non è stato dimostrato (a differenza del melanoma cutaneo in cui il ruolo delle radiazioni UV gioca un ruolo di primaria importanza).
Caratteristiche cliniche
L’uvea è un tessuto vascolare composto da vasi sanguigni e melanociti, le cellule che producono la melanina (sostanza che assorbe la luce solare proteggendo le cellule) anche a livello cutaneo. Questa struttura anatomica ha un colorito bruno ed ha diversi compiti: nutrire la retina tramite i numerosi vasi sanguigni nella sua porzione posteriore, chiamata coroide; produrre l’umore acqueo e regolare la pressione dell’occhio nella sua porzione intermedia chiamata corpo ciliare; regolare la quantità di luce che entra nell’occhio con la sua porzione anteriore chiamata iride, visibile anche dall’esterno e responsabile del caratteristico colore degli occhi. Il melanoma dell’uvea posteriore è definito come melanoma del corpo ciliare e/o della coroide. Il melanoma dell’iride è invece da considerarsi un sottotipo meno aggressivo e più raro dei precedenti (meno del 5% dei melanomi uveali).
Tra i melanomi dell’uvea posteriore, il melanoma del corpo ciliare è a sua volta meno frequente di quello coroideale (10% – 15% del totale). Caratteristicamente rimane per lungo tempo asintomatico, dovendo raggiungere dimensioni notevoli prima di coinvolgere l’asse ottico (linea teorica che unisce il centro della pupilla con il centro della retina, la macula, attraverso la quale passa la luce che utilizziamo per la visione dei dettagli) e quindi manifestarsi con sintomatologia che classicamente è caratterizzata da deficit visivo, fosfeni (lampi luminosi) e metamorfopsie (visione distorta). Modalità di presentazione meno comuni includono la sublussazione del cristallino (spostamento del cristallino di lato da parte della massa), l’insorgenza di astigmatismo (dovuto sempre all’effetto spinta della massa con curvatura del cristallino in sede di contatto) e l’insorgenza di cataratta. Segno tipico di tali lesioni è anche la presenza di uno o più vasi episclerali dilatati, definiti vasi sentinella. Il tumore dei corpi ciliari, generalmente non visibile dall’esterno dell’occhio perché localizzato dietro l’iride, può talvolta estendersi anteriormente all’iride stessa e alla camera anteriore, o addirittura al di fuori della sclera, rendendosi visibile come una macchia marrone sulla porzione bianca del bulbo oculare.
Il melanoma coroideale si sviluppa anch’esso inizialmente in maniera asintomatica, almeno nelle sue fasi iniziali, e diventa sintomatico quando coinvolge la macula, sede della visione dettagliata, causando una riduzione dell’acuità visiva. Altri sintomi aspecifici sono, come per la controparte a partenza dai corpi ciliari, la percezione di fosfeni e un deficit del campo visivo, che possono essere attribuiti alla lesione stessa o alla contemporanea presenza di distacco retinico causato dalla lesione.
All’esame oftalmoscopico il melanoma coroideale si presenta come una massa nodulare cupoliforme, che cresce sotto la retina, iperpigmentata (di colorito brunastro) (figura 1), frequentemente associata a distacco sieroso retinico causato dalla perdita di liquido sotto la retina da parte dei vasi tumorali anomali. Melanomi di dimensioni maggiori possono provocare la rottura della membrana di Bruch e assumere un aspetto a fungo (figura 2).
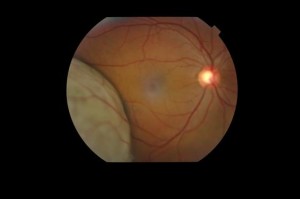
Fig.1: Melanoma della coroide (*) localizzato vicino alla macula (§). Si noti la forma a cupola (tondeggiante) e il colorito marroncino.
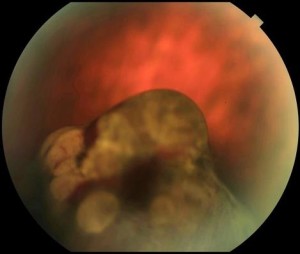
Fig. 2: Melanoma dell’uvea localizzato nei settori periferici, caratterizzato da rotture multiple della membrana di Bruch con aspetto multinodulare e minuti fenomeni emorragici in superficie.
Diagnosi
L’esame del fundus dell’occhio permette di diagnosticare il melanoma dell’uvea posteriore in modo sensibile e specifico. Inoltre, la diagnosi e le dimensioni del tumore devono essere confermate tramite tecniche ancillari, in particolare l’ecografia, che permette di studiare la struttura della massa e caratterizzarla.
L’angiografia retinica con fluoresceina e indocianina, la TC, la RM, l’OCT (Optical Coherence Tomography) e la FNAB (Fine Needle Aspiration Biopsy ) trovano spazio solo in casi selezionati, in quanto la diagnosi di melanoma coroideale è primitivamente clinica ed ecografica.
L’ecografia (figura 3) è necessaria per misurare il diametro e lo spessore della lesione e quindi per la scelta del trattamento e la successiva valutazione della progressione o della regressione della neoplasia. Permette inoltre di porre diagnosi di melanoma dell’uvea posteriore anche in caso di co-patologie che non permettano una visualizzazione diretta della neoplasia, quali una cataratta densa.
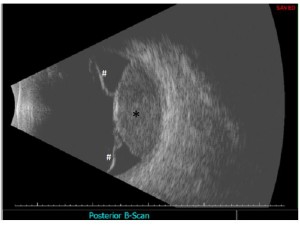
Fig. 3: Ecografia B-Can – melanoma della coroide cupoliforme (*) associato a distacco sieroso della retina perilesionale (#).
Trattamento del melanoma coroideale
Attualmente la radioterapia conservativa ha quasi completamente sostituito le altre opzioni terapeutiche utilizzate precedentemente, quali l’enucleazione del bulbo oculare (la rimozione del bulbo oculare e la ricostruzione estetica mediante protesi mobile). Ciò è stato reso possibile in seguito all’analisi dei risultati del Collaborative Ocular Melanoma Study (COMS), che ha dimostrato che i tassi di sopravvivenza dei pazienti affetti da melanomi coroideali di medie e grandi dimensioni sottoposti ad enucleazione del bulbo oculare non differiscono da quelli trattati conservativamente con brachiterapia, terapia caratterizzata dal posizionamento sulla superficie oculare di una sorgente (placca radiante) delle dimensioni di una moneta, che irradia direttamente la neoplasia.
Poichè la radioterapia conservativa non è associata ad un aumentato rischio di metastasi rispetto alla terapia demolitiva, l’enucleazione è oggi riservata solo ai pazienti non trattabili con terapia conservativa a causa delle elevate dimensioni della lesione, o a pazienti affetti da melanoma uveale che presentino complicanze tardive della patologia, quali un glaucoma neovascolare, un’invasione del nervo ottico o un’estensione extraoculare della malattia. L’enucleazione secondaria è indicata in caso di recidiva di tumore già trattato con terapia conservativa o in caso di complicanze di quest’ultima, che determinino la presenza di un bulbo cieco e dolente senza possibilità di recupero visivo.
La brachiterapia è la metodica più diffusa di trattamento conservativo nel melanoma coroideale. Gli isotopi attualmente più utilizzati sono lo Iodio 125 e il Rutenio 106. Meno diffusa è la terapia protonica, di efficacia sovrapponibile a quella della brachiterapia, e con alcune specifiche e peculiari indicazioni.
La placca radiante utilizzata per la brachiterapia (Figura 4), caricata dell’isotopo radioattivo, viene suturata sulla superficie del bulbo oculare in corrispondenza della zona dove al suo interno è localizzata la lesione da trattare. Il calcolo dosimetrico della radiazione necessaria per il trattamento del tumore viene effettuato in sede preoperatoria dal fisico medico e dal radioterapista, in base ai parametri forniti dall’oculista, principalmente ricavati dalle misurazioni ottenute mediante ecografia a-b scan. La placca radiante viene lasciata in sede per il tempo necessario all’emissione della dose prescritta, 85-100 Gy all’apice del tumore, per una durata media del trattamento di 3 – 5 giorni. Le radiazioni ionizzanti assorbite dal tessuto tumorale provocano la produzione di radicali liberi, danneggiando il DNA cellulare con successiva morte cellulare e regressione della lesione (figura 5).
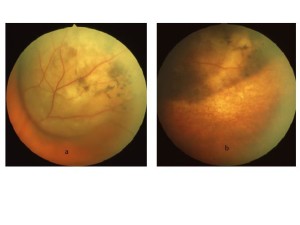
Fig. 5: Melanoma coroideale prima (a) e dopo (b) il trattamento brachiterapico con I 125. Notare la riduzione volumetrica della lesione.
Il fallimento del trattamento brachiterapico è principalmente associato alla presenza di tumori di grandi dimensioni e alla presenza di estrinsecazione extraoculare della massa. Le principali complicanze del trattamento radiante sono il glaucoma neovascolare, la cataratta da radiazioni, il distacco retinico essudativo persistente, la maculopatia e l’otticopatia da radiazioni. Alcune terapie quali la fotocoagulazione laser o l’iniezione intraoculare di corticosteroidi possono prevenire o rallentare l’insorgenza di tali complicanze.
Un altro trattamento meno comune del melanoma coroideale, introdotto per la minor insorgenza di complicanze visive, ma riservato a casi attentamente selezionati, è la termoterapia transpupillare. Tale trattamento consiste nella distruzione tramite ipertermia del tumore utilizzando una sorgente laser. Purtroppo però questo trattamento è gravato da percentuali di recidiva locale maggiori rispetto alla terapia radiante.
Prognosi citogenetica
L’analisi delle caratteristiche genetiche del tumore viene oggi eseguita su materiale prelevato mediante citoaspirazione con ago sottile (microprelievo) eseguito in fase di trattamento della neoplasia. Questo tipo di analisi è stato introdotto nella pratica clinica perché oggi considerato lo strumento più sensibile e specifico per personalizzare la prognosi del paziente. E’ stato infatti dimostrato che la presenza intratumorale di specifiche alterazioni genetiche, quale per esempio la presenza di un solo cromosoma 3 (monosomia 3, Figura 6), abbia una correlazione significativa con il rischio metastatico del paziente, e che quindi sia un fattore prognostico sfavorevole. Questo dato permette quindi di caratterizzare i singoli pazienti a basso o alto rischio di sviluppare metastasi, permettendo pertanto di personalizzare il follow-up in modo paziente-specifico.
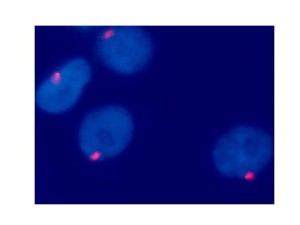
Fig. 6: Cellule di melanoma coroideale (ovali azzurri) analizzate con tecnica FISH (Fluorescence in-situ Hybridization). Queste cellule sono caratterizzate da una monosomia del cromosoma 3, cioè un solo cromosoma 3
(singolo puntino rosso all’interno di ogni cellula), invece che due cromosomi 3 come tutte le cellule normali (sarebbero visibili due puntini rossi per cellula).
Malattia metastatica e suo trattamento
Nonostante i recenti progressi avvenuti sia nella diagnosi che nel controllo locale della neoplasia, i tassi di sopravvivenza sono rimasti sostanzialmente invariati negli anni. Ancora oggi circa il 50% dei pazienti colpiti da melanoma coroideale sviluppa malattia metastatica. Una volta riscontrate lesioni secondarie, la prognosi è generalmente infausta, anche se la situazione sta cominciando a migliorare soprattutto in seguito alla recente introduzione di terapie locoregionali mirate.
Le cellule di melanoma, per loro caratteristica biologica, ma anche per l’assenza di vasi linfatici a livello coroideale, diffondono esclusivamente per via ematica. La sede più frequente di metastasi è il fegato, seguito da cute, polmoni e encefalo, che raramente sono sede di metastasi senza il contemporaneo coinvolgimento epatico.
In caso di metastasi presenti a livello epatico, sono state elaborate delle strategie di trattamento locoregionale, che hanno portato a risultati incoraggianti in termini di regressione/stabilizzazione delle metastasi come anche di aumentata sopravvivenza. Tra queste, la più efficace è la chemioembolizzazione trans-arteriosa delle metastasi epatiche.
Altri tipi di approccio locoregionale includono la chemioterapia sistemica e il trattamento chirurgico delle metastasi, consigliato per lesioni uniche ed accessibili ad una chirurgia radicale. I pazienti trattati chirurgicamente hanno mostrato una sopravvivenza significativamente più lunga rispetto ai precedenti approcci, ma un intervento radicale è possibile solo nel 25% circa dei soggetti.

