1. Introduzione
La terapia genica, che consiste nella somministrazione intracellulare di materiale genetico sia allo scopo di bloccare un gene disfunzionale che come strumento terapeutico, ha un potenziale enorme per il trattamento di malattie retiniche con componente genetica. Nonostante ciò, il potenziale rischio rende ancora necessari studi clinici per aumentarne sicurezza ed efficacia. In realtà, l’applicazione clinica della terapia genica è attualmente limitata alle malattie gravi della retina per le quali non esiste alcun trattamento.
L’occhio possiede importanti vantaggi per quanto riguarda la terapia genica: presenta un’anatomia ben definita, è relativamente isolato dal sistema immunitario, facilmente accessibile ed altrettanto facilmente esaminato, e, nello stesso paziente, un occhio può essere utilizzato come bersaglio sperimentale e l’occhio controlaterale come controllo. I progressi nella terapia genica sono molto promettenti per la gestione di condizioni oftalmiche, e la terapia genica oculare è stato ampiamente esplorata negli ultimi anni come via terapeutica per colpire le malattie della retina e dell’epitelio pigmentato retinico (EPR). Il successo della terapia genica si basa sulla somministrazione efficace del materiale genetico alle cellule bersaglio, ottenendo un’espressione genica ottimale a lungo termine.
2. Arrivo del gene nell’occhio: i metodi di somministrazione
Per curare le malattie oculari con la terapia genica tre parametri principali devono essere perfettamente selezionati: la via di somministrazione, il sistema di erogazione e l’uso di specifici elementi promotori.
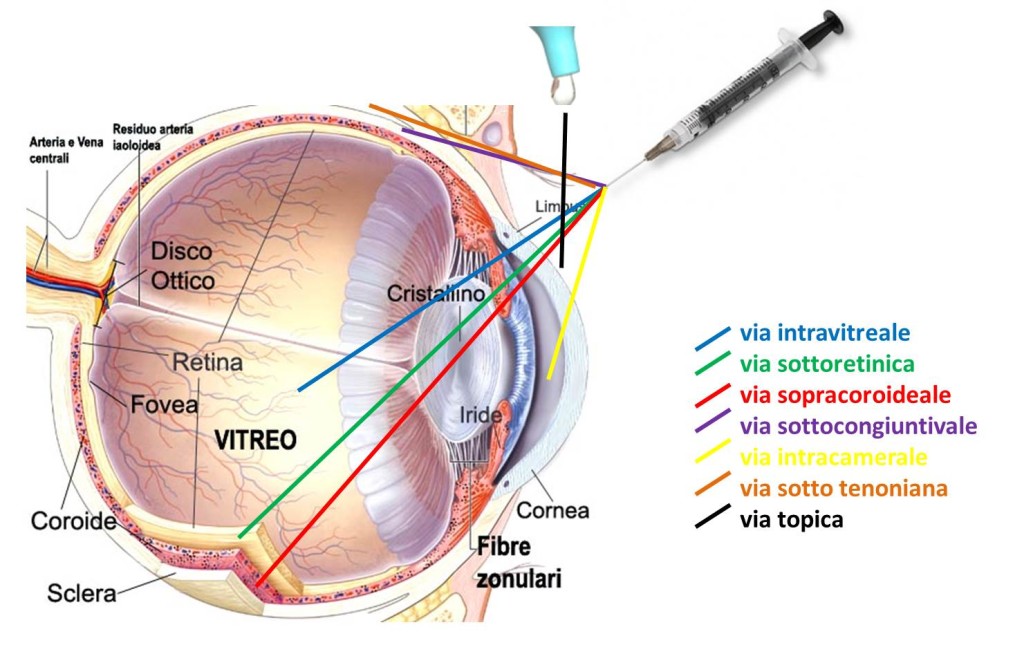
2.1. Vie di somministrazione oculari
La somministrazione oculare del gene può avvenire attraverso diverse vie che comprendono l’instillazione topica, vie perioculari, iniezione nella camera anteriore (tra iride e cornea), iniezione intravitreale, iniezione sottoretinica o sovracoroideale (Fig. 1). ciascuna di queste vie di somministrazione presenta vantaggi e svantaggi, e la scelta deve essere basata sulle cellule bersaglio e le sulle caratteristiche del vettore utilizzato.
2.1.1. instillazione topica
La somministrazione topica è il metodo più semplice e non invasivo con cui un farmaco raggiunge l’occhio. Tuttavia, specie per le grandi molecole come gli acidi nucleici, la biodisponibilità oculare del farmaco instillato è molto scarsa. Da un lato, una grossa porzione del farmaco somministrat per via topica è drenata dalla superficie oculare e persino assorbito nella circolazione sistemica attraverso i vasi congiuntivali e nasali. Inoltre la penetrazione attraverso la cornea e l’epitelio congiuntivale per raggiungere camera posteriore dell’occhio è limitata, come già detto, dalla dimensione degli acidi nucleici. Pertanto, la via topica è solitamente limitata per il trattamento di malattie legate al segmento anteriore dell’occhio.
2.1.2. Vie perioculari
Il termine “vie perioculari” comprende la somministrazione di farmaci per via peribulbare, retrobulbare, iuxtasclerale posteriore, sotto-tenoniana e l’iniezione sottocongiuntivale, quest’ultimo il metodo più studiato per la somministrazione di acidi nucleici. L’iniezione sottocongiuntivale è infatti un metodo poco invasivo che permette la somministrazione di grandi volumi e che può essere ripetuto, se necessario. Attraverso questo percorso, i farmaci possono penetrare nel segmento anteriore e posteriore dell’occhio, ma le potenziali complicanze possono essere legate all’assorbimento sistemico del farmaco. Il destino delle particelle e delle molecole iniettate per via sottocongiuntivale dipende dalla dimensione: particelle più grandi (> 200 nm) sono trattenute per lungo tempo nello spazio congiuntivale e sono più appropriate per una consegna costante di camera anteriore. Gli acidi nucleici, grazie al loro alto peso molecolare permangono nel sito di iniezione senza possibilità di penetrazione potenzialmente pericolosa in altri tessuti oculari o nella circolazione sistemica.
2.1.3. iniezione Intracamerale
La somministrazione degli acidi nucleici nella camera anteriore dell’occhio induce trasduzione dei tessuti del segmento anteriore, anche se il continuo ricambio di umore acqueo e il tempo di contatto limitato con il tessuto oculare ne possono limitare l’efficacia.
2.1.4. iniezione intravitreale
La somministrazione di farmaco mediante iniezione intravitreale è stata ampiamente studiata come via d’accesso alle strutture vitreali e retiniche. La somministrazione nell’umor vitreo è relativamente facile, e consente dosi relativamente alte, anche se si possono verificare eventi avversi, come il distacco di retina, l’endoftalmite e l’aumento di della pressione intraoculare.
2.1.5. iniezione sottoretinica
L’iniezione dei vettori nello spazio sottoretinico permette il contatto diretto degli acidi nucleici con fotorecettori, con gli strati retinici esterni e con le cellule dell’epitelio pigmentato retinico. Pertanto, questa via è particolarmente utile per il trattamento delle degenerazioni retiniche causate da mutazioni genetiche nei fotorecettori o nell’epitelio pigmentato retinico. Tuttavia, come l’iniezione intravitreale, anche la somministrazione sottoretinica è un metodo invasivo e vi è il rischio di danno oculare, come lesioni dell’epitelio pigmentato retinico, emorragie, rotture retiniche, fibrosi sotto- o pre-retinica, distacco di retina. La somministrazione sottoretinica è stato impiegata in studi clinici per il trattamento dell’Amaurosi Congenita di Leber di tipo 2 (LCA2) con risultati molto promettenti.
2.1.6. iniezione sovracoroideale
Anche la via sovracoroideale, sotto la sclera e sopra la coroide, è stata esplorata per la somministrazione di farmaci al segmento posteriore dell’occhio. Questa via di somministrazione non interferisce con l’asse visivo e migliora l’accesso per diffusione alla coroide, ma le macromolecole vengono eliminate rapidamente e formulazioni a lento rilascio si rendono necessarie per una maggior durata.
2.2. Sistemi di trasporto
Il sistema di trasporto ideale di un gene dovrebbe essere captato efficiente e ampiamente nel tessuto bersaglio dopo una somministrazione il meno invasiva possibile, e senza espressione ectopica. Nei trattamenti genici delle malattie croniche, l’espressione genica dovrebbe iniziare velocemente, essere abbastanza alta da indurre miglioramento fenotipico e continuare a lungo. Inoltre, il vettore deve essere ben tollerato e non causare effetti collaterali, come infiammazione, risposta immunitaria ot tossicità. La ricerca di una terapia genica efficace per le malattie retiniche ha condotto allo sviluppo di diversi sistemi di trasporto. Tra questi, i vettori virali sono stati ampiamente utilizzati, ma il loro potenziale rischio associato all’ immunogenicità, alla mutagenesi e anche alla persistenza nel cervello, ha promosso la progettazione di vettori non virali alternativi. I vettori non virali sono meno immunogenici, non provocano risposte infiammatorie oculari gravi, sono sicuri e facili da produrre in grande scala, sebbene il loro limite principale rimanga la bassa efficacia di trasfezione.
2.2.1. Vettori virali
Ad oggi i vettori virali continuano ad essere il sistema di erogazione genetica di scelta per le malattie oculari. Diversi vettori virali sono stati impiegati per consegnare i geni ai tessuti oculari, tra cui adenovirus, virus adeno-associati, retrovirus e lentivirus. La selezione del vettore virale più appropriato dipenderà dalla cellula bersaglio e dalla durata della risposta.
2.2.1.1. Vettori adenovirali
Gli adenovirus sono vettori a doppio filamento di DNA in grado di transfettare efficacemente sia cellule in divisione che non. Questi vettori mostrano diversi vantaggi che li rendono interessanti per la terapia genica: non integrano il loro acido nucleico nel genoma ospitante, evitando così il rischio di mutagenesi, sono facili da amplificare e purificare, e possono incorporare geni di grandi dimensioni. Tuttavia, gli adenovirus di solito inducono risposte immunitarie e la durata dell’espressione genica è breve. Pertanto gli adenovirus hanno un potenziale utilizzo in scenari in cui sia necessaria un’espressione genica transitoria, come nella sovraespressione di proteine nell’epitelio corneale di pazienti con diabete mellito, ma la loro applicazione per difetti genetici ereditari è scoraggiata. Gli adenovirus ricombinanti sono stati progettati come vettori per i geni coinvolti nella retinite pigmentosa, la degenerazione maculare legata all’età, o la retinopatia diabetica. Recentemente, adenovirus trasportatori di tre diversi geni (Ascl1, Brn3b e Ngn2) sono stati utilizzati per riprogrammare ex vivo i fibroblasti di topo a cellule retiniche simil-ganglionari.
2.2.1.2. Vettori virali adeno-associato
I virus adeno-associati sono vettori non patogeni a DNA a singolo filamento in grado di trasdurre cellule a divisione lenta o non in divisione, e fornire espressione transgenica a lungo termine, che può persistere fino a 6 anni dopo una singola dose. Tale efficacia di trasduzione e specificità dipendono non solo dal sierotipo ma anche sul capside. Nella retina, la somministrazione sottoretinica di vettore virale adeno-associato di tipo 2 risulta nella trasduzione di cellule dell’epitelio pigmentato retinico o di fotorecettori cellule, mentre la sua iniezione intravitreale porta a trasduzione di cellule gangliari. L’esperienza ha dimostrato che i virus adenoassociati di tipo 2 con capside 5 e con capside 8 sono i due sierotipi più efficaci per colpire i fotorecettori.
2.2.1.3. Vettori lentivirali
I lentivirus sono vettori ad RNA a singolo filamento che possiedono proprietà distinte che li rendono particolarmente adatti per il trasporto di geni nelle malattie oftalmiche: espressione elevata e stabile, capacità di infettare cellule in divisione e non, nonché cellule primarie, e la mancanza di infiammazione intraoculare associata. I vettori lentivirali, altamente soppressi, auto-inattivanti e non-integranti sono stati sviluppati come alternative più sicure; infatti, eventi avversi clinicamente gravi non sono stati riportati con questo tipo di vettori. I vettori lentivirali sono in grado di trasdurre cellule retiniche, e sono stati studiati come vettori per diversi geni correlati alla distrofie retiniche quali la subunità beta della fosfodiesterasi del GMPc (PDEbeta) dei bastoncelli, l’RPE65 o la proteina trasportatrice della adenosina trifosfato (ATP) binding-cassette (ABCA4) specifica dei fotorecettori. Binley et al. hanno progettato un vettore lentivirale che esprime la proteine angiostatica endostatina e angiostatina, da somministrare tramite un’iniezione sottoretinica per il trattamento della forma umida della degenerazione maculare legata all’età (RetinoStat®). I lentivirus sono stati recentemente segnalati come vettori per l’RNA inattivante (RNAi) con utilità potenziale nel trattamento della retinopatia diabetica, della retinopatia del prematuro e altre malattie oculari neovascolari.
2.2.1.4. Vettori retrovirali
I vettori retrovirali sono anch’essi virus a RNA ma con capacità oncogenetica, cosa che implica un rischio maggiore di eventi avversi gravi. L’uso di retrovirus per la terapia genica è stato drasticamente ridotto a causa dello sviluppo di leucemia a cellule T.
2.2.2. Vettori non virali
Nonostante il significativo successo con vettori virali, gli approcci non-virali vengono ampiamente esplorati, dal momento che la loro progettazione controllata offre la possibilità di raggiungere risultati più efficienti. Un tipico vettore non-virale contiene un composto cationico che lega elettrostaticamente il materiale genetico. L’acido nucleico è così protetto, e il risultante vettore cationico facilita anche l’adesione alla superficie cellulare e la successiva endocitosi. La natura dei vettori non virali è generalmente lipidica o polimerica.
2.2.2.1. Vettori a base di lipidi
L’incapsulamento liposomiale di acidi nucleici si è rivelato efficace per trasfettare lo strato retinico interno e l’epitelio pigmentato retinico. L’instillazione topica di liposomi porta alla trasfezione delle cellule ganglionari della retina. L’iniezione nel vitreo o nello spazio sottoretinico comporta l’espressione del gene nelle cellule ganglionari della retina e nell’epitelio pigmentato retinico.
2.2.2.2. Vettori a base di polimeri
Molti nuovi polimeri biodegradabili, come la polietilenimmina, i poliesteri, il chitosano, l’acido ialuronico, l’albumina, o la poli-L-lisina, sono in fase di studio come vettori di terapia genica.
2.3. Elementi promotori
L’espressione del gene trasportato solo quando necessario può essere ottenuta utilizzando promotori sensibili a specifici segnali ambientali. L’inclusione di un promotore sensibile all’ipossia che venga messo a tacere in condizioni di normale ossigenazione è stata proposta come strategia per disturbi neovascolari come la retinopatia diabetica e la degenerazione maculare legata all’età. In altri casi, l’espressione genica si verifica dopo la somministrazione di un farmaco induttore.
- L’applicazione della terapia genica nelle malattie oculari
Come accennato in precedenza, la terapia genica per il trattamento delle malattie oculari ha diversi vantaggi, resi tali dalla facile accessibilità dell’occhio e dal fatto che molte sindromi degenerative della retina sono ben caratterizzate da un punto di vista genetico.
3.2. Retinoschisi X-linked (XLR)
La retinoschisi X-linked, che deriva da mutazioni nel gene che codifica per la proteina retinoschisina, è una malattia degenerativa della retina che colpisce tra 1/5000 e 1/25.000 persone in tutto il mondo, con formazione di cavità cistiche nella retina interna e deterioramento della visione causato da disorganizzazione retina. Attualmente non esiste una cura per la formazione della schisi, ma essendo la causa di questa malattia monogenica recessiva ben compresa, è un ottima candidata per la terapia genetica. Precedenti studi hanno dimostrato che la consegna di una copia normale del gene RS1 tramite vettori adenovirali può migliorare la degenerazione. Tuttavia gli studi sugli esseri umani sono carenti. Lo sviluppo di vettori non virali è una promettente alternativa per tentare il trattamento della retinoschisi X-linked con terapia genica.
3.3. malattia di Stargardt
La malattia di Stargardt è la più frequente degenerazione maculare giovanile ereditaria, con diagnosi solitamente intorno ai vent’anni. Le caratteristiche distintive di questa malattia autosomica recessiva sono la perdita della visione centrale e problemi nell’adattamento al buio. Il gene coinvolto nella malattia di Stargardt è ABCA4, e codifica per una proteina trasportatrice espressa esclusivamente nella retina e nei coni. La perdita della vista nei pazienti con Stargardt può essere dovuta a centinaia di mutazioni nel gene ABCA4. La terapia genica è una strategia logica per la malattia di Stargardt, sebbene la grande dimensione del DNA di ABCA4 ne impedisca il trasporto tramite un classico vettore adenovirale (massima capacità di circa 4,7 kb). In questo senso, i dati preclinici su vettori lentivirali hanno supportato il primo studio clinico in pazienti con malattia di Stargardt che è attualmente in corso (StarGen, Clinical-Trials.gov, NCT01367444).
3.4. Coroideremia
La coroideremia è una distrofia corioretinica X-linked che colpisce soggetti di sesso maschile con una prevalenza stimata di 1:50.000. Essa è caratterizzata da atrofia progressiva della coroide, EPR, e fotorecettori. Il gene associato a questa malattia è il gene CHM; mutazioni nel gene causano difetti di traffico fra le cellule. In pazienti con questa malattia oculare, l’acuità visiva è generalmente buona fino alla tardiva affezione della fovea. Negli studi clinici sulla terapia genica nella coroideremia, l’incremento della sensibilità retinica è stato correlato con la dose di vettore somministrata per via sottoretinica (inducendo un distacco di retina). i risultati ottenuti in questi studi clinici dimostrano che il miglioramento della funzione dei fotorecettori supera gli effetti negativi del distacco di retina indotto dalla somministrazione sottoretinica del gene. Questi risultati supportano ulteriori indagini su l’applicazione della terapia genica per il trattamento della coroideremia prima della comparsa dell’assottigliamento della retina.
3.5. Retinite pigmentosa
La retinite pigmentosa è il tipo più comune di degenerazione retinica, responsabile della perdita della vista in 1:4000 persone in tutto il mondo. La retinite pigmentosa può derivare da un difetto di qualsiasi fra 60 geni ereditati in maniera autosomica dominante (30-40% dei casi), autosomica recessiva (50-60%), o X-linked (5-15%). I pazienti hanno spesso cecità notturna nelle prime fasi della malattia, seguita da perdita della vista dalla periferia verso il centro che porta a visione “a tunnel”. La terapia genica è stata valutata in modelli animali di retinite pigmentosa, ed i risultati forniscono aspettative incoraggianti per future applicazioni cliniche. Tuttavia, al momento, la traduzione clinica ha bisogno di una più profonda conoscenza delle mutazioni e dei meccanismi che sottintendono la retinite pigmentosa.
3.6. Degenerazione maculare legata all’età
La degenerazione maculare legata all’età è la principale causa di perdita visiva centrale irreversibile nelle persone di età superiore ai 50 anni nei paesi sviluppati. Colpisce la visione centrale e l’acuità visiva per distanza, compromettendo la capacità di leggere, di riconoscere i volti delle persone, e di eseguire attività quotidiane come scegliere i vestiti. Il rischio di degenerazione maculare legata all’età coinvolge molti fattori, ma il contributo genetico è ben noto. Il Consorzio Gene AMD ha recentemente pubblicato un’ analisi completa del rischio AMD, includendo cui più di 17.000 casi e più di 60.000 controlli. Questo studio ha fornito informazioni molto utili, tra cui l’identificazione di geni alla base della degenerazione maculare legata all’età; tuttavia, la conoscenza dei driver genetici per la progressione della degenerazione maculare legata all’età è ancora insufficiente. Uno studio clinico in fase 1 su 28 pazienti con degenerazione maculare legata all’età neovascolare utilizza il trasferimento genico intravitreale del”pigment epithelium derived factor (PEDF), una citochina antiangiogenica che sembra arrestare la crescita della membrana neovascolare. La terapia genica per la degenerazione maculare legata all’età può anche essere intrapresa con RNAi. PF-04523655 è un siRNA che inibisce l’espressione gene RTP801, indotto in risposta all’ipossia e/o allo stress ossidativo, che porta alla induzione di apoptosi neuronale. PF-04523655 è stato somministrato come singola iniezione intravitreale in uno studio multicentrico di fase 1. E ‘stato ben tollerato senza qualsiasi problema di sicurezza. Tuttavia, la dimensione del campione limitata non era sufficiente per valutare statisticamente l’efficacia.
3.7. Amaurosi Congenita di Leber
L’ amaurosi congenita di Leber è una malattia autosomica recessiva derivante dalla mutazione in almeno 15 geni. I pazienti con questa grave malattia della retina soffrono di una marcata compromissione dell’acuità visiva alla nascita o durante i primi sei mesi di vita. Fino ad ora, non vi è alcun trattamento efficace per l’amaurosi congenita di Leber, e la terapia genica è ampiamente indagata. La mutazione più comune è una mutazione intronica in CEP290 che si traduce nell’inclusione di un esone aberrante nell’mRNA. In uno studio recente, è stato sviluppato un vettore lentivirale contenente il gene CEP209. In un altro studio che impiegava cellule linfoblastoidi immortalizzate di pazienti con amaurosi congenita di Leber con mutazione intronica CEP290, i pazienti venivano transfettati con diversi oligonucleotidi antisenso per colpire l’esone aberrante incorporato nell’mRNA mutato. I risultati mostravano che il numero di oligonucleotidi era quasi sufficiente per ricreare uno splicing normale di CEP290. La carenza dell’idrolasi del retinile-tutto-trans dovuta a mutazione nel gene RPE65 riguarda il 6% dei casi di amaurosi congenita di Leber. Una terapia genica per l’amaurosi congenita di Leber legata a RPE65 è stata studiata in quattro studi clinici indipendenti nei quali ha portato a marcati miglioramenti della funzione visiva nel giro di giorni o settimane dal trattamento, miglioramento che viene mantenuto per l’intera durata dello studio (3 anni). Va però precisato che, sebbene la terapia genica induca un miglioramento visivo così marcato e durevole, non rallenta la degenerazione dei fotorecettori.
4. Conclusioni
La terapia genica oculare è un approccio promettente per trattare, rallentare o prevenire le patologie modificando l’espressione genica negli occhi. La terapia genuica è ancora agli inizi, e i risultati sull’uomo sono ancora in fase sperimentale, anche se promettenti. Una maggiore comprensione delle mutazioni e dei meccanismi che causano i deficit visivi, insieme allo sviluppo di vettori più efficaci, saranno cruciali per lo sviluppo di trattamenti efficaci per il futuro.